Un enlace químico es la fuerza que mantiene unidos a los átomos en una molécula o en un compuesto. Se forma cuando los átomos comparten, ganan o pierden electrones con el fin de alcanzar una configuración electrónica más estable.
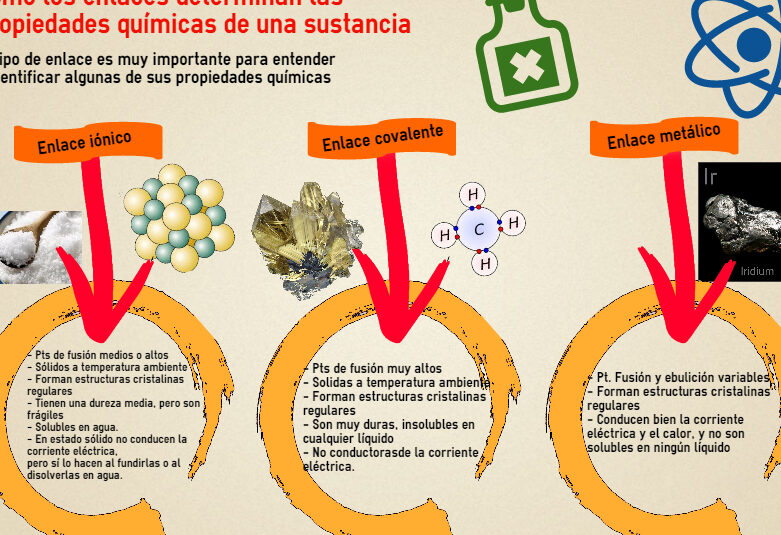
Existen diferentes tipos de enlaces químicos, como el enlace iónico, covalente y metálico. En el enlace iónico, los átomos se unen a través de la atracción electrostática entre iones con carga opuesta. En el enlace covalente, los átomos comparten electrones para completar sus niveles de energía. Y en el enlace metálico, los átomos se unen formando una red tridimensional en la cual los electrones se desplazan libremente.
El tipo de enlace químico presente en una sustancia determina sus propiedades físicas y químicas. Por ejemplo, las sustancias iónicas tienden a tener puntos de fusión y ebullición elevados, ya que los enlaces iónicos son fuertes y requieren mucha energía para romperse. Además, las sustancias iónicas suelen ser sólidas y conductoras de la electricidad cuando están disueltas o fundidas, ya que los iones pueden moverse libremente.
En contraste, las sustancias covalentes suelen tener puntos de fusión y ebullición más bajos, ya que los enlaces covalentes son más débiles. Estas sustancias pueden ser sólidas, líquidas o gaseosas, dependiendo de la fuerza de los enlaces y de las interacciones intermoleculares. Además, las sustancias covalentes suelen ser malas conductoras de la electricidad, ya que los electrones están fuertemente compartidos entre los átomos.
Por otro lado, los enlaces metálicos confieren a las sustancias propiedades como la conductividad eléctrica y térmica, la maleabilidad y la ductilidad. Esto se debe a que los electrones en los enlaces metálicos se desplazan libremente a través de la estructura metálica, permitiendo la conducción de la electricidad y el calor. Además, los enlaces metálicos son flexibles, lo que permite que los metales se puedan deformar sin romperse.
Enlace químico y propiedades: todo lo que debes saber
El enlace químico es un concepto fundamental en la química que se encarga de explicar cómo los átomos se unen para formar moléculas y compuestos. Comprender el enlace químico es esencial para entender las propiedades y comportamientos de las sustancias químicas.
Existen diferentes tipos de enlaces químicos, como el enlace iónico, covalente y metálico, cada uno con sus propias características y propiedades. El enlace iónico se forma entre átomos de diferentes elementos cuando uno de ellos cede electrones y el otro los acepta. Esto da lugar a la formación de iones positivos y negativos, que se atraen mutuamente generando una fuerza de atracción electrostática.
Por otro lado, el enlace covalente se forma cuando dos átomos comparten electrones para completar su estructura de valencia. Este tipo de enlace es más común entre átomos no metálicos y puede ser polar o no polar, dependiendo de la diferencia de electronegatividad entre los átomos.
Finalmente, el enlace metálico se da en los metales, donde los átomos se encuentran en una estructura cristalina y comparten sus electrones de valencia de forma delocalizada. Esto da lugar a la formación de una red tridimensional de electrones que confiere a los metales sus propiedades características, como la conductividad eléctrica y térmica.
Las propiedades de una sustancia química están directamente relacionadas con el tipo de enlace que forma.
Por ejemplo, los compuestos iónicos tienden a tener puntos de fusión y ebullición elevados debido a la fuerte atracción electrostática entre los iones. Además, suelen ser sólidos cristalinos y buenos conductores de la electricidad en estado fundido o disuelto en agua.
Los compuestos covalentes, por otro lado, pueden ser sólidos, líquidos o gases a temperatura ambiente, dependiendo de la fuerza del enlace y la forma en que las moléculas se organizan. También pueden ser buenos aislantes eléctricos, ya que los electrones están compartidos entre los átomos de la molécula y no se mueven con facilidad.
En cuanto a los metales, su enlace metálico les confiere propiedades como la maleabilidad, la ductilidad y la alta conductividad eléctrica y térmica. Esto se debe a la facilidad con la que los electrones se desplazan a través de la red cristalina, permitiendo el flujo de corriente eléctrica y el transporte de calor.
Impacto de las propiedades en el enlace químico
El enlace químico es una fuerza que mantiene unidos a los átomos en una molécula o en un cristal. Este enlace se forma cuando los átomos comparten, ceden o reciben electrones, lo que da lugar a diferentes tipos de enlaces como el enlace iónico, covalente y metálico.
Las propiedades de los átomos involucrados en el enlace químico tienen un impacto significativo en la naturaleza y la fuerza del enlace. Estas propiedades incluyen el tamaño del átomo, la electronegatividad, la valencia y la estructura electrónica.
El tamaño del átomo es determinante en el enlace químico, ya que átomos más pequeños tienden a formar enlaces más fuertes que los átomos más grandes. Esto se debe a que los electrones están más cerca del núcleo y, por lo tanto, la atracción entre los electrones y los núcleos es más fuerte. Por ejemplo, en el enlace covalente, si dos átomos son de tamaños similares, la fuerza del enlace será mayor.
La electronegatividad es otra propiedad importante que afecta al enlace químico. La electronegatividad es la capacidad de un átomo de atraer electrones hacia sí mismo. En el enlace iónico, por ejemplo, un átomo con alta electronegatividad tiende a atraer los electrones de otro átomo con baja electronegatividad, lo que genera una atracción electrostática y forma un enlace iónico.
La valencia de un átomo también influye en el enlace químico. La valencia representa la capacidad de un átomo para formar enlaces químicos. Átomos con valencias altas tienden a formar enlaces más fuertes, ya que pueden compartir o ceder más electrones. Por ejemplo, el carbono tiene una valencia de 4, lo que le permite formar enlaces covalentes estables con otros átomos.
La estructura electrónica de un átomo es otro factor clave en el enlace químico. La configuración electrónica determina cómo están dispuestos los electrones en los niveles de energía del átomo. Esto influye en la estabilidad del átomo y en su capacidad para formar enlaces químicos. Por ejemplo, los átomos con una configuración electrónica completa en su nivel de valencia tienden a ser estables y no forman enlaces fácilmente.
¡Descubre cómo los enlaces químicos transforman la materia!
