En un átomo, la cantidad de electrones visibles puede variar dependiendo de su configuración electrónica. Sin embargo, en general, solo se pueden apreciar un número limitado de electrones en un átomo.
Para entender esto, es importante recordar que los electrones se distribuyen en diferentes niveles de energía alrededor del núcleo del átomo. Cada nivel de energía tiene una capacidad máxima de electrones que puede alojar. El nivel más cercano al núcleo, llamado nivel 1 o K, puede alojar un máximo de 2 electrones. El siguiente nivel, el nivel 2 o L, puede alojar un máximo de 8 electrones. A partir de ahí, los niveles sucesivos pueden alojar cada uno hasta un máximo de 18 electrones (nivel 3 o M), 32 electrones (nivel 4 o N), y así sucesivamente.
Dado que los electrones están distribuidos en diferentes niveles de energía, solo los electrones del nivel más externo, conocidos como electrones de valencia, son los que están más lejos del núcleo y pueden interactuar con otros átomos. Estos electrones de valencia son los responsables de las propiedades químicas de un elemento.
En general, solo se pueden apreciar los electrones de valencia en un átomo, ya que los electrones de los niveles más internos están más cerca del núcleo y no pueden ser detectados directamente. Por lo tanto, la cantidad de electrones visibles en un átomo depende de la configuración electrónica del elemento en cuestión y la posición que ocupa en la tabla periódica.
Número máximo de electrones en un átomo
El número máximo de electrones en un átomo está determinado por la estructura de niveles de energía y la distribución electrónica. Para entender esto, primero debemos comprender que los electrones se distribuyen en capas o niveles de energía alrededor del núcleo del átomo.
El primer nivel de energía, conocido como nivel K, puede albergar un máximo de 2 electrones. El segundo nivel, nivel L, puede contener hasta 8 electrones. El tercer nivel, nivel M, puede tener hasta 18 electrones, y así sucesivamente.
Es importante destacar que estos números máximos de electrones se basan en el modelo de átomo en estado fundamental, es decir, cuando no se le ha aplicado ninguna energía adicional que pueda excitar a los electrones a niveles superiores.
Además, es importante mencionar que los electrones se distribuyen en subniveles dentro de cada nivel de energía. Estos subniveles se representan con las letras s, p, d y f, y tienen diferentes números máximos de electrones.
El subnivel s puede albergar un máximo de 2 electrones, el subnivel p puede contener hasta 6 electrones, el subnivel d puede tener hasta 10 electrones, y el subnivel f puede contener hasta 14 electrones.
Por lo tanto, la distribución electrónica de un átomo se rige por reglas específicas, como la regla de Aufbau y la regla de Hund, que determinan cómo los electrones se llenan en los diferentes niveles y subniveles de energía.
Número máximo de electrones en cada nivel: descúbrelo ahora
Si estás interesado en conocer el número máximo de electrones que puede contener cada nivel en un átomo, has llegado al lugar indicado. En este artículo, te proporcionaré toda la información que necesitas saber sobre este tema fascinante.
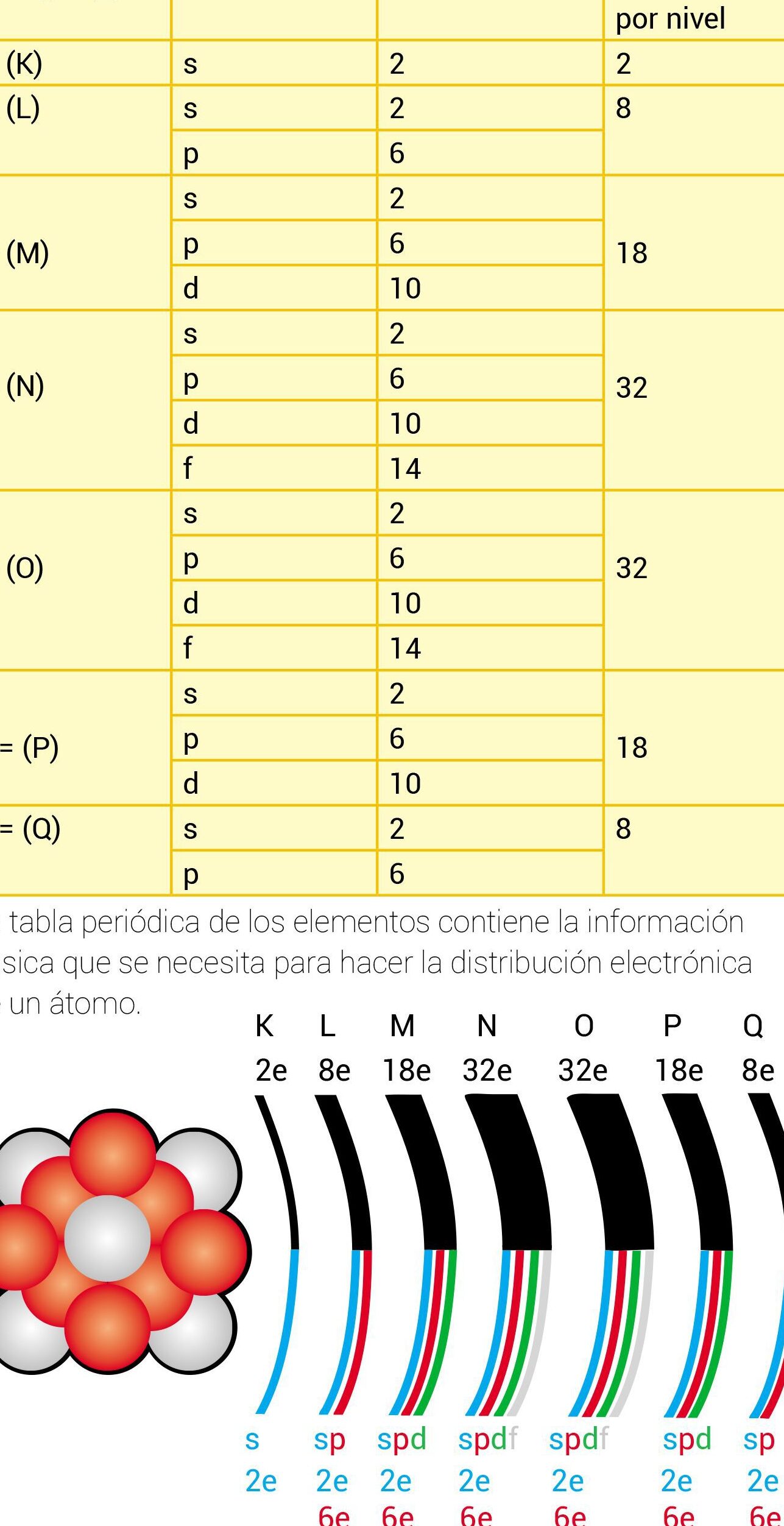
Antes de adentrarnos en los detalles, es importante comprender cómo se organizan los electrones en un átomo. Los electrones, partículas subatómicas con carga negativa, se encuentran distribuidos en diferentes niveles energéticos alrededor del núcleo del átomo. Estos niveles, también conocidos como capas o niveles de energía, son representados por las letras K, L, M, N, O, P, Q, en orden creciente.
Cada nivel de energía tiene una capacidad máxima de electrones que puede alojar. La fórmula para determinar esta capacidad es 2n^2, donde «n» representa el número del nivel de energía. Por ejemplo, el nivel K (n = 1) puede contener un máximo de 2(1)^2 = 2 electrones. El nivel L (n = 2) puede alojar hasta 2(2)^2 = 8 electrones.
A medida que avanzamos en los niveles de energía, la capacidad máxima de electrones aumenta. El nivel M (n = 3) puede contener hasta 2(3)^2 = 18 electrones, el nivel N (n = 4) hasta 2(4)^2 = 32 electrones, y así sucesivamente.
Es importante destacar que la capacidad máxima de electrones en cada nivel es teórica y se basa en el modelo atómico de Schrödinger. Sin embargo, en la realidad, algunos elementos pueden presentar excepciones a esta regla debido a su configuración electrónica única.
A continuación, te presento una lista con el número máximo de electrones en cada nivel:
- Nivel K: 2 electrones
- Nivel L: 8 electrones
- Nivel M: 18 electrones
- Nivel N: 32 electrones
- Nivel O: 32 electrones
- Nivel P: 18 electrones
- Nivel Q: 2 electrones
Como puedes observar, la capacidad máxima de electrones en cada nivel sigue un patrón ascendente hasta alcanzar el nivel N, donde se produce una ligera disminución en la capacidad. Esto se debe a la forma en que se llenan los orbitales y a la configuración electrónica de los elementos.
Descubre el fascinante mundo de los electrones.
